Du behandelst in der Schule gerade Atome und Schalenmodelle oder möchtest dein Wissen darüber einfach nochmal auffrischen? Dann bist du hier richtig. Dieser Artikel wird dir in wenigen Minuten alles Wichtige darlegen.
Legen wir los!
Das Schalenmodell beschreibt den Aufbau von Atomen. Dem Modell liegt das Bohrschen Atommodell zu Grunde und es enthält ein paar Elemente aus dem Orbitalmodell.
Das Modell kannst du dir so vorstellen:
Der Atomkern ist in der Mitte, um ihn herum sind Schalen zu finden. In diesen Schalen befinden sich die Elektronen, deshalb nennt man die Schalen auch Elektronenschalen.
Was ist ein Atom?
Alles was wir sehen, anfassen, riechen, schmecken und hören besteht aus Atomen. Atome sind sozusagen viele winzige Teile, die einen Stoff bilden. Diese Stoffe können flüssig, gasförmig oder fest sein.
Atomaufbau – einfach erklärt
Damals ging man bei Atomen davon aus, dass sie unteilbar sind.
Heute aber weiß man, dass ein Atom aus einem Atomkern
und einer Atomhülle besteht.
Atomkern
Im Atomkern befinden sich sowohl Protonen als auch Neutronen. Protonen sind positiv geladene Teilchen und die Neutronen sind neutral geladene Teilchen. Der Atomkern ist positiv geladen.
Die Protonen und Neutronen nennt man auch Nukleonen, diese sind durch starke Wechselwirkungen aneinander gebunden. Obwohl der Kern im Vergleich zur Hülle kleiner ist, befindet sich 99,9% der Masse im Atomkern.
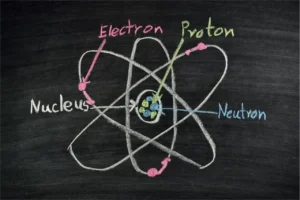
Protonen
Die Protonenanzahl eines Atoms bleibt immer gleich. Im Periodensystem wird die Protonenanzahl als Ordnungszahl Z festgelegt. Diese bestimmen die Elektronenschalen des Atoms.
Neutronen
Bei Neutronen kann man auch von Isotopen sprechen, da die Neutronenanzahl N des Atoms unterschiedlich sein kann.
Elektronen
Elektronen sind negativ geladene Teilchen und befinden sich in der Atomhülle. Die Hülle besteht aus einzelnen Schalen.
Sind genauso viele Protonen wie Elektronen vorhanden, spricht man von einem neutralen Atom mit keiner Ladung. Ist das Atom jedoch positiv oder negativ geladen, ist die Rede von einem Ion.
Man kann die Elektronen in der Atomhülle nicht einfach willkürlich verteilen. Denn jede Schale hat eine bestimmte Anzahl von Elektronen, die sie aufnehmen kann. Die Besetzung der Schalen sieht folgendermaßen aus:
Die Rolle des Periodensystems
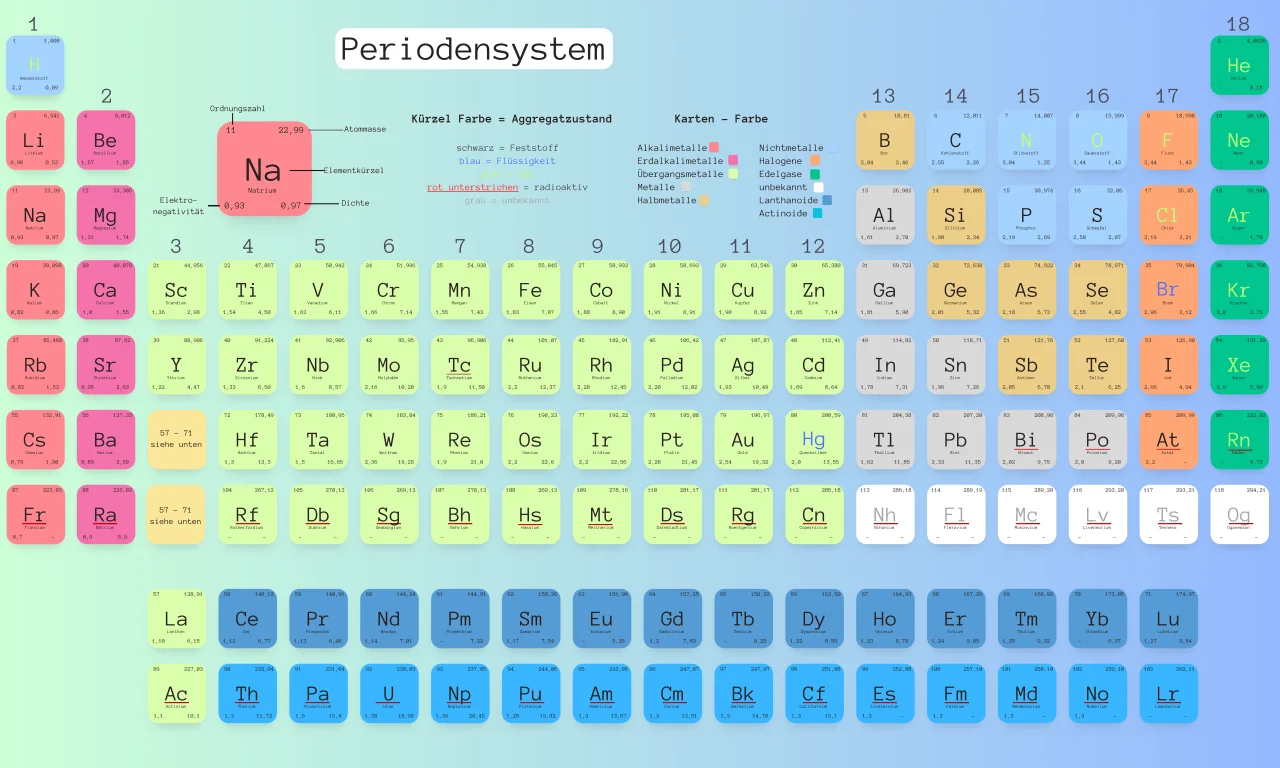
Das Periodensystem der Elemente ist in der Chemie eine Tabelle, in der alle Elemente dargestellt sind. Alle Elemente sind nach Ordnungszahl, Perioden und Gruppen sortiert.
Durch das Periodensystem ist es einfacher, die Schalenmodelle für jedes Element der Hauptgruppen darzustellen.
Aufbau des Periodensystems
Wie gerade schon erwähnt, ist das Periodensystem in Perioden und in Gruppen eingeteilt. Insgesamt gibt es 7 Perioden und 8 Hauptgruppen. Hauptgruppen, denn zwischen der zweiten und der dritten Hauptgruppe befinden sich weitere 10 Gruppen.
Diese nennt man Nebengruppen. Sie sind ebenfalls nach ihrer Ordnungszahl geordnet. Wichtig und nicht zu vergessen ist, dass das Schalenmodell nicht dafür geeignet ist, die Nebengruppen zu zeichnen.
Die Alkalimetalle besitzen in ihrer äußersten Schale (Valenzschale) nur ein Elektron.
Die Halogene besitzen in ihrer äußersten Hülle sieben Elektronen. Diese Elemente sind reaktiver als die Edelmetalle.
Die Edelgase besitzen in ihrer äußersten Schale (Valenzschale) acht Elektronen. Bei so einem Zustand spricht man von einem Edelgaszustand. Diese Elemente sind sehr unreaktiv.
Schalenmodell zeichnen – Schritt für Schritt
Beim Zeichnen eines Schalenmodells eines Elements musst du dir im Klaren darüber sein, in welchen Perioden es sich befindet. Die Perioden entsprechen der Anzahl der Schalen.
H befindet sich in der ersten Periode und hat somit nur eine K-Schale.
Dann hältst du Ausschau nach der Ordnungszahl. Diese bestimmt die Anzahl der Elektronen, die du auf den Schalen verteilen musst.
Die Hauptgruppe sagt dir, wie viele Elektronen in die äußerste Hülle kommen.
Kohlenstoff – C befindet sich in der vierten Hauptgruppe, besitzt 6 Elektronen und befindet sich in der zweiten Periode.
Das heißt, dass Kohlenstoff – C aus zwei Schalen besteht (K- und L-Schalen) und 4 Elektronen sich in der L-Schale befinden.
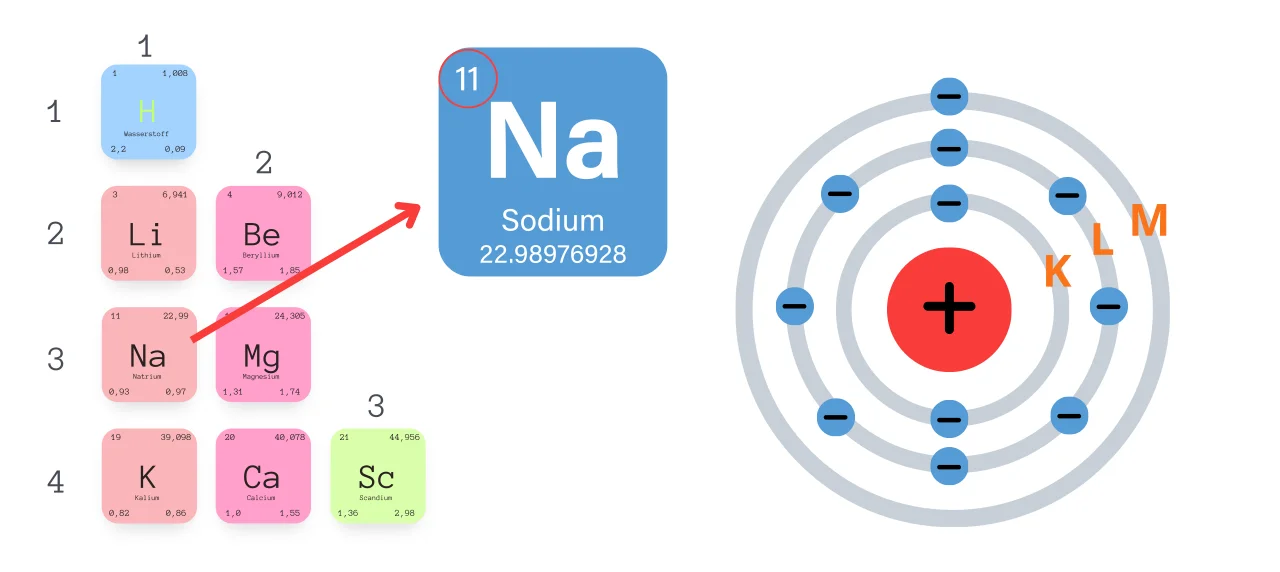
Schalenmodell Beispiel an Natrium (Na)
Man fängt mit der Besetzung immer von der inneren Schale an. Dabei gilt es dann, die Schalen voll zu besetzen bevor es mit der nächsten Schale weitergeht.
Was ebenfalls wichtig ist und was du dir merken musst ist, dass dieses Model nur für die Hauptgruppen des Periodensystems geeignet ist.
Natrium hat die Ordnungszahl 11 und somit in der ersten Schale 2 Elektronen, in der zweiten Schale 8 Elektronen und in der dritten Schale 1 Elektron.
Bereit selbst Schalenmodelle zu zeichnen?
Schalenmodell – kostenlose Aufgaben
Trau dich und erstelle die Schalenmodelle für folgende Elemente.
1) Zeichne die Schalenmodelle
1.Magnesium
2. Sauerstoff
3. Phosphor
2) Schreibe in Schalen.
1. Kalium
2. Brom
3. Chlor
Schalenmodell – FAQ
Wie werden die Schalen beschriftet?
Die Schalen werden von innen nach außen ab dem Buchstaben K beschriftet.
Was ist das PSE?
Das PSE ist das Kürzel für das Periodensystem der Elemente.
Wie viele Elektronen kann die 3 Schale annehmen?
Bis zu 18 Elektronen.
Was heißt die Periode für das Schalenmodell?
Wenn sich das Element in der dritten Periode befindet, dann hat das Element drei Schalen.
