Dich verwirrt die galvanische Zelle und alles was dazu gehört? – Kein Thema! Wir zeigen dir in folgenden Punkten wie sie in ihren verschiedensten Arten funktioniert:
- Der Aufbau der galvanischen Zelle
- Die Redoxreihe
- Das Daniell-Element – Stufenweise Erklärung
Fang direkt an zu lesen und finde im Anschluss des Artikels die passenden Lernzettel und Arbeitsblatt mit Lösungen zur Kurzschreibweise, um das Thema: Galvanische Zelle für dich zu verinnerlichen!
Galvanische Zelle - Definition
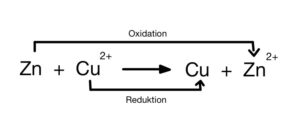
Die galvanische Zelle ist ein System, bei dem chemische in elektrische Energie umgewandelt wird. Sie besteht aus einer Donator- (Oxidation) und einer Akzeptorhalbzelle (Reduktion).
So haben wir im Alltag die Möglichkeit, beispielsweise durch eine Powerbank (tragbarer Strom) unsere Handys aufladen zu können.
Es handelt sich um eine Redoxreaktion. Der Aufbau der galvanischen Zelle fasst sich in zwei Halbzellen zusammen, die leitend miteinander verbunden sind:
Zelldiagramm der galvanischen Zelle
Im folgenden wird Schritt für Schritt die galvanische Zelle mit der zugehörigen Beschriftung dargestellt.
Galvanische Zelle-Beispiel/ Reaktionsgleichung: Zink- und Kupfer-Kathoden.
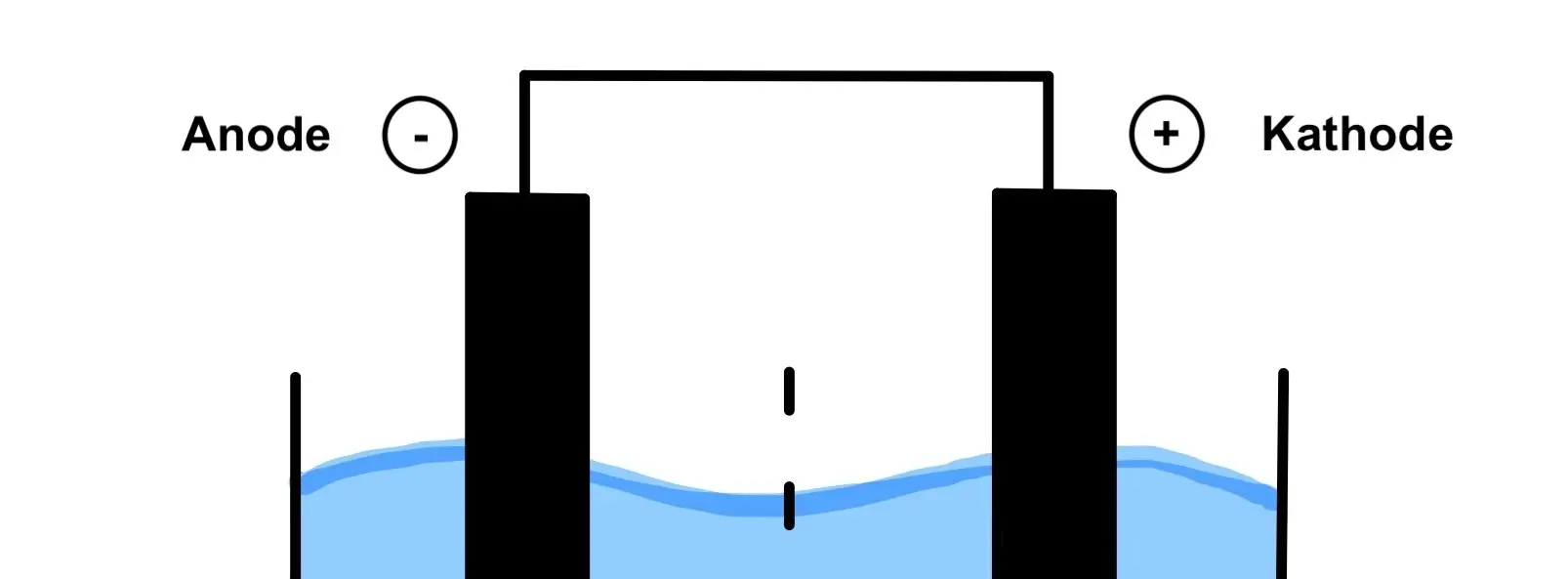
In beiden Halbzellen befindet sich je eine Elektrode:
- Metall – Kathode: Negativ geladen
- Metall – Anode: Positiv geladen
Beide sind über einen elektrisch leitenden Draht verbunden.
Diese Elektroden befinden sich in einer (oder zwei verschiedenen) elektrisch leitfähigen Flüssigkeit(en) (Elektrolytlösung). Es handelt sich um eine dem Metall entsprechenden Metalllösung, die als Ionenleiter dient.
Beispiel:
Es handelt sich um Zink (Zn). Somit wird eine Zinklösung genutzt (ZnSO4).
Gleichzeitig wird ein Elektronenleiter benötigt. Die Elektrode selbst bildet diesen Leiter.
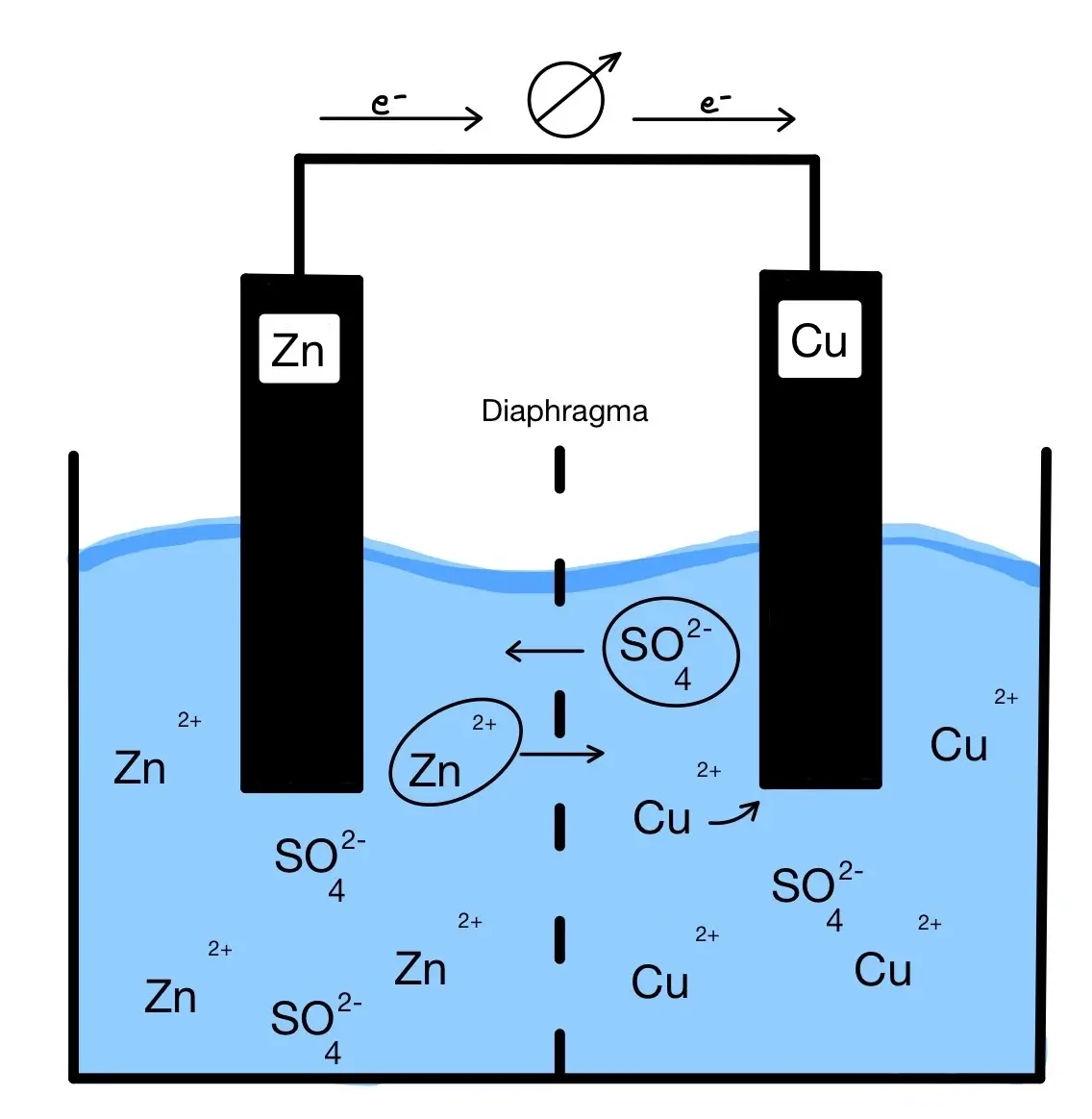
Damit ein geschlossener Stromkreis entsteht und damit ein Ladungsausgleich vorliegt, sind beide Halbzellen mit einer porösen Trennwand voneinander getrennt. Dieses ist nur für Ionen passierbar ist.
Wenn man nun ein Spannungsgerät zwischen beiden Halbzellen anschließt, kann man die Zellspannung ablesen. Ebenso hilft die Nernst Gleichung, um die Spannung zu berechnen.
Der Unterschied zwischen der galvanischen Zelle und einer Elektrolyse
Galvanische Zelle
Anode: Minuspol
Kathode: Pluspol
→ Umwandlung von chemischer Energie zur elektrischen Energie
→ freiwillige Reaktion
Elektrolyse
Anode: Pluspol
Kathode: Minuspol
→ Umkehrreaktion der galvanischen Zelle
→ Umwandlung von elektrischer Energie zur chemischen Energie
→ Gezwungene Reaktion
Galvanische Zelle – Funktionsweise der Redoxreihe
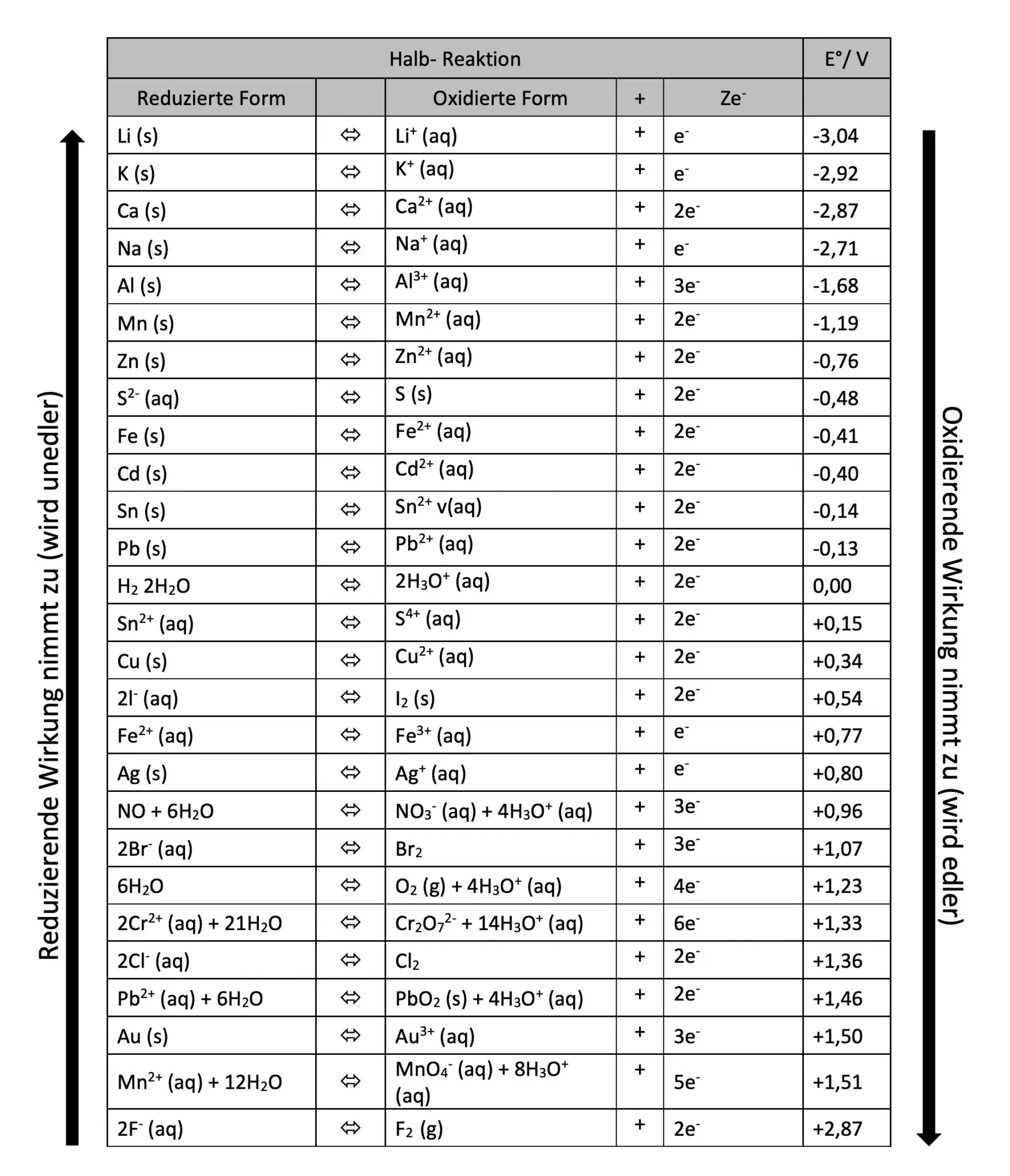
In der Redoxreihe sind die Elemente nach ihrem Redoxpotenzial (Standardpotenzial oder auch die Breitwilligkeit Elektronen abzugeben) angeordnet. Die Elektronen fließen immer vom unedleren zum edleren Metall, also immer von der Anode zu Kathode.
Um zu wissen, welches Metall unedler ist, haben wir dir die Redoxreihe Zusammengestellt. Aus dieser kannst du herauslesen:
Redoxreihe
Je weiter unten ein Element steht, desto unedler ist es und gibt lieber Elektronen ab.
Je weiter oben ein Element steht, desto edler ist es und gibt nicht so gerne Elektronen ab.
Schreibweise
Wie wir eben gelernt haben, fließen die Elektronen immer vom unedleren zum edleren Metall. Demnach stellt das unedlere Metall die Anode und das edlere Metall die Kathode dar.
Durch folgende Redoxreihe herausgefunden werden, welches Metall unedler ist:
Für die galvanische Zelle wird die Kurzschreibweise genutzt. Bei dieser wird die Anode auf die linke und die Kathode auf die rechte Seite geschrieben.
Beispiel: Zn / Zn²+ // Cu²+ I/ Cu
Trennwand
Galvanische Zelle – Weitere Beispiele:
1. Lithium (Li) ist edler als Calcium (Ca): Ca / Ca²+ // Li+ + Li
→ Anode: Calcium
→ Kathode: Litium
2. Zink (Zn) ist edler als Mangan (Mn): Mn / Mn²+ // Zn²+ / Zn
→ Anode: Mangan
→ Kathode: Zink
Das Daniell – Element
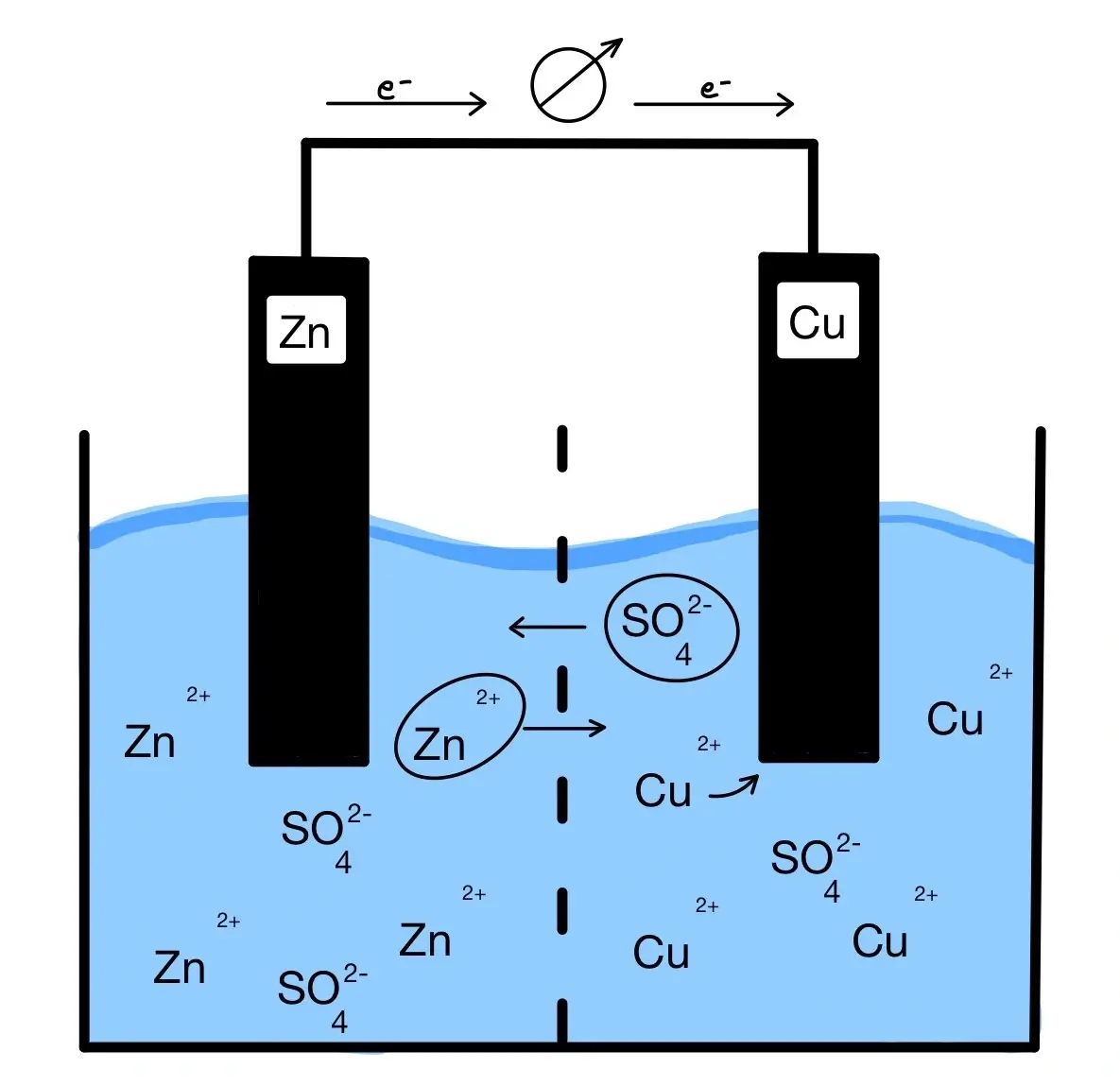
Auch das Daniell – Element ist eine galvanische Zelle. Sie besteht aus einer Zink- und einer Kupferhalbzelle.
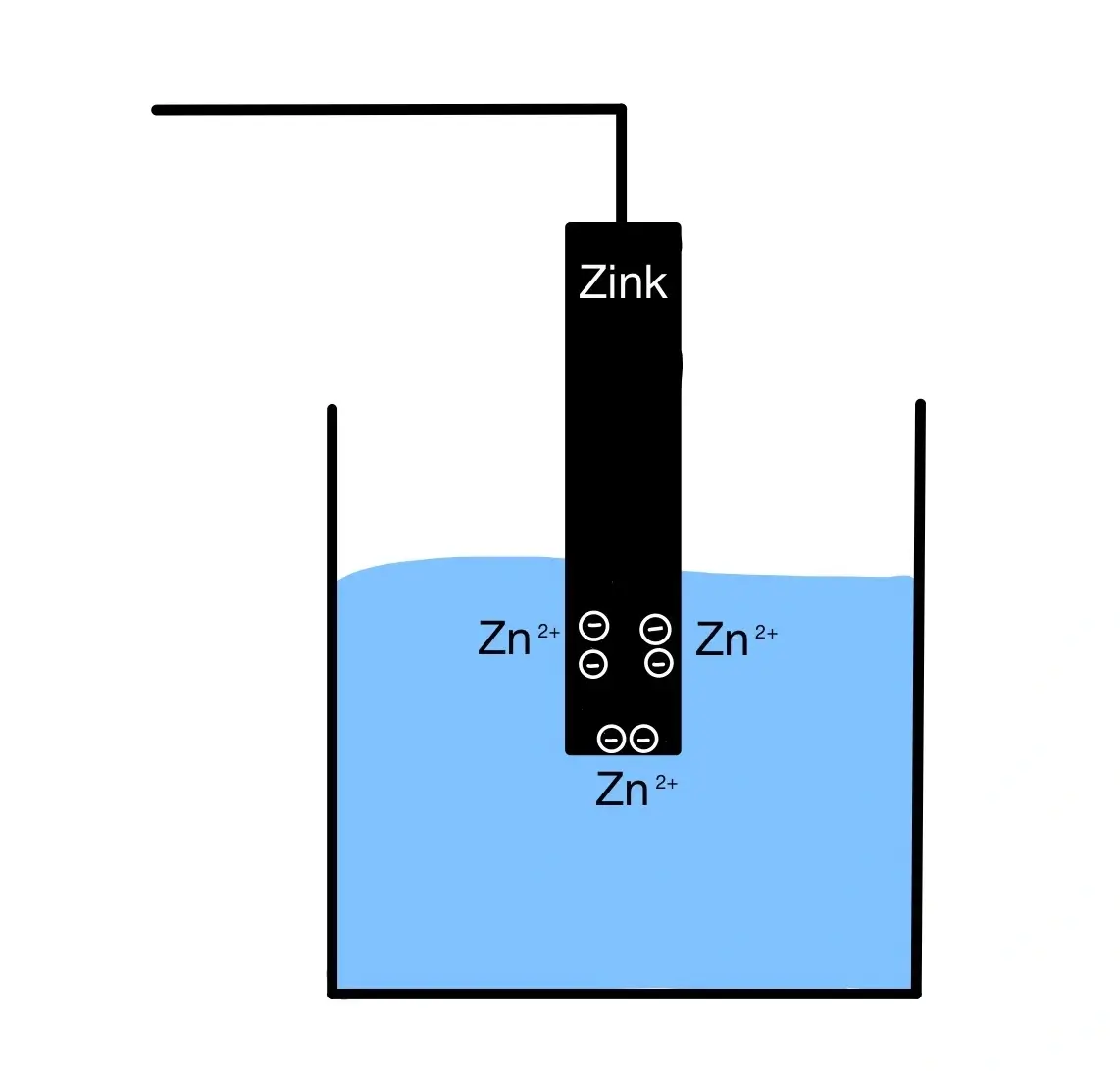
Durch das Eintauchen der Elektrode in die Lösung, entsteht ein Gleichgewicht zwischen der Elektrode und den gelösten Ionen:
Zn (s) ⇔ Zn²+ + 2e¯
Cu (s) ⇔ Cu²+ + 2e¯
Kupfer ist unedler als Zink. Demnach gibt Kupfer weniger Elektronen ab und weniger Kupferionen gehen in Lösung.
Zink hingegen gibt, da es edler ist, mehr Elektronen ab und damit mehr Ionen in die Lösung. Damit ist Zink negativer als Kupfer.
Prozess der galvanischen Zelle im Daniell – Element
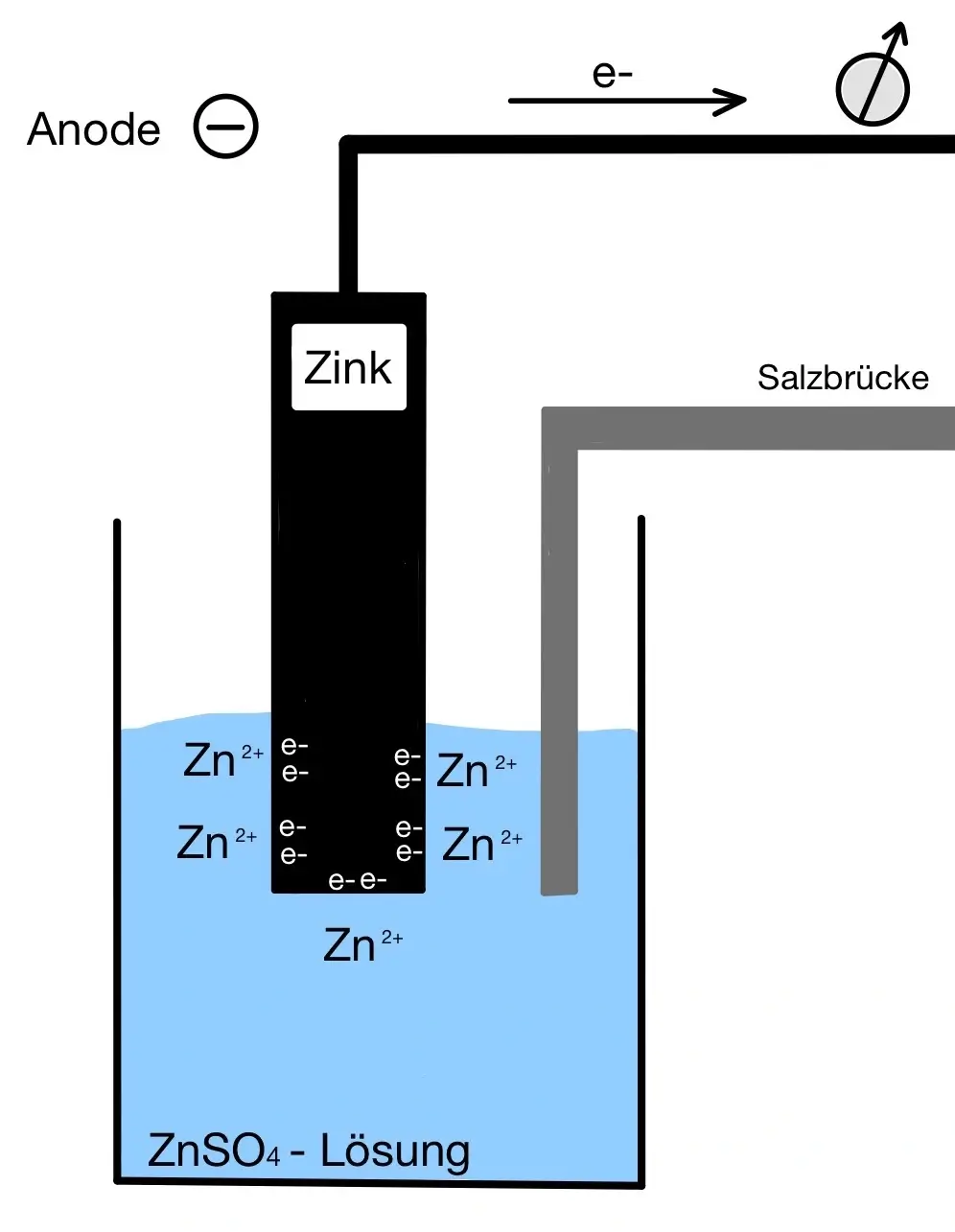
Punk 1
Nachdem Zink zu Zn²+ oxidiert wird, werden die Ionen in die ZnSO4 – Lösung abgegeben. Es folgt ein Überschuss an Kationen in der Halbzelle und ein Überschuss an Elektronen in der Elektrode selbst. Dieser Überschuss in der Elektrode herrscht durch die große Anzahl an negativen Ladungen in der Elektrode.
Punkt 2
Um diesen Druck zu entweichen, werden die Elektronen über einen Kupferdraht in die Kupferelektrode übertragen.
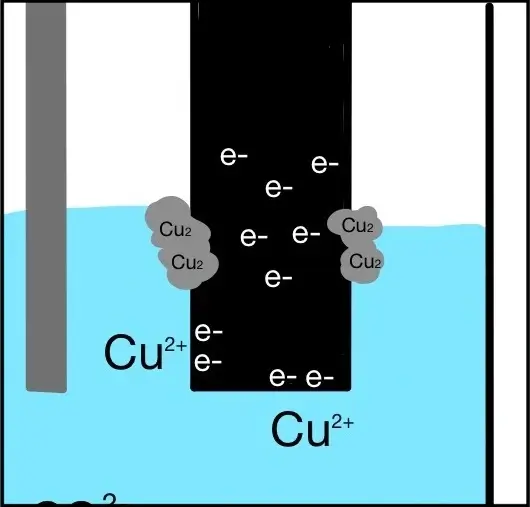
Punkt 3
Die übertragenen Elektronen werden von den gelösten Kupferionen aufgenommen. Sie werden zu elementaren Kupfer, der sich an der Kupferelektrode anlagert.
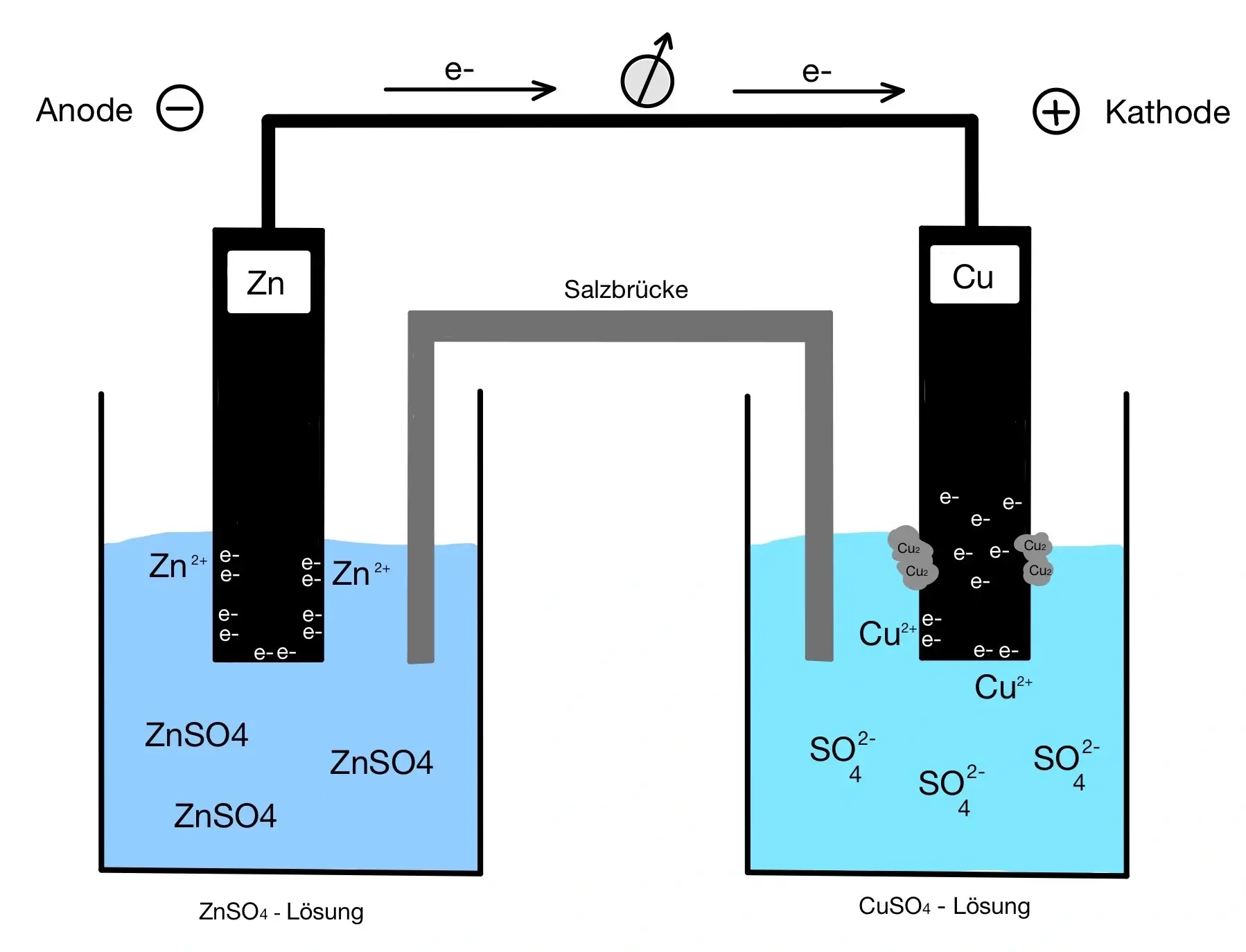
Punkt 4
Da nun keine Cu²+ – Ionen für die Lösung mehr übrig sind, befinden sich nun die Sulfatanionen (SO4²¯) in der Überzahl. Es folgt:
- ein Überschuss der Sulfatanionen in der zweiten Halbzelle
- ein Überschuss an Zn²+ in der ersten Halbzelle.
Punkt 5
Um einen Ausgleich zu schaffen helfen sich die Sulfatanionen und Zinkkationen gegenseitig über eine poröse Trennwand, in dem Fall der Salzbrücke, aus. Dies geschieht, indem sie in die jeweilig andere Halbzelle fließen.
Es bildet sich eine elektrische Doppelschicht.
Der Stromfluss ist dabei allerdings nur möglich, soweit der Stromkreislauf geschlossen ist. Um dies zu erreichen, wird die Elektrolytbrücke eingesetzt.
Merke:
Je länger das Daniell – Element in Betrieb ist, desto schmaler wird die Zinkelektrode und desto mehr Masse erlangt die Kupferelektrode.
Diese Artikel könnten dich auch interessieren: