Wie erklären wir uns den Atomaufbau? Aus welchen Teilen besteht ein Atom? Was für Atommodelle gibt es? Diese Fragen und mehr werden wir zusammen in diesem Artikel beantworten.
Wie ist ein Atom aufgebaut?
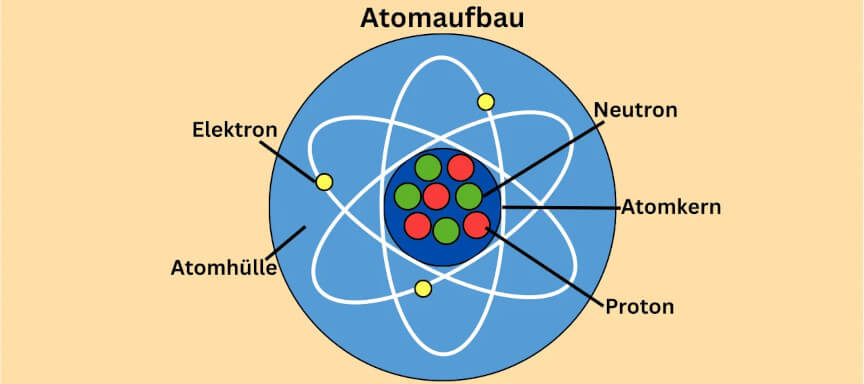
Ein Atom besteht aus einem Atomkern und einer Atomhülle. Im Atomkern befinden sich Protonen und Neutronen. In der Atomhülle kreisen die Elektronen um den Atomkern.
Wusstest du, dass...
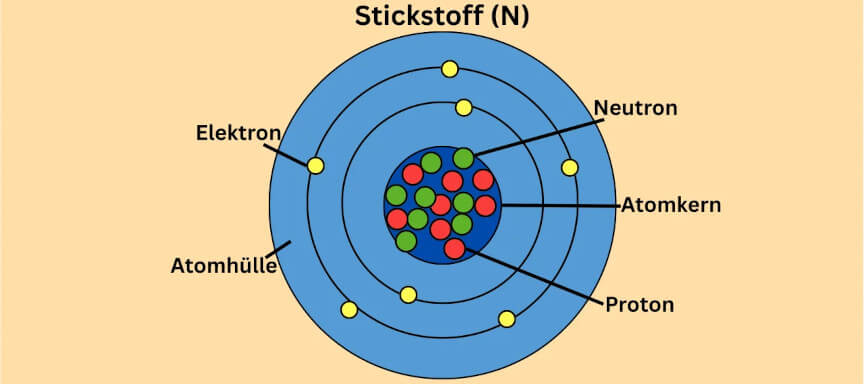
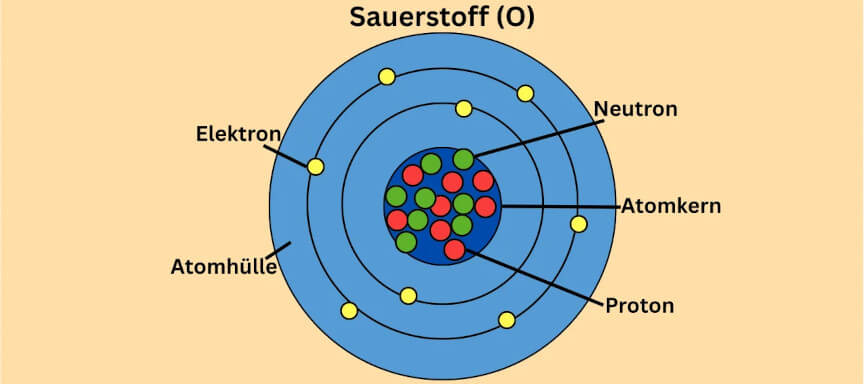
die vier häufigsten Atome in unserem Körper Sauerstoff, Kohlenstoff, Wasserstoff und Stickstoff sind? Sie machen zusammen mehr als 99 Prozent der Atome in unserem Körper aus.
Atomaufbau: Kern
Im Zentrum des Atoms befindet sich der Atomkern, bestehend aus zwei Teilen:
- Protonen (positiv geladen)
- Neutronen (neutral, ohne Ladung)
Das Element des Atoms wird anhand der Anzahl der Protonen bestimmt, während die Neutronen für Stabilität im Kern sorgen.
Auch wenn der Atomkern winzig klein ist, enthält er fast die gesamte Masse des Atoms (ca. 99,9%). Sehen wir uns die Masse der einzelnen Teile genauer an:
- Masse eines Protons

- Masse eines Neutrons
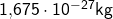
- Masse eines Elektron

Die Masse eines Elektrons ist also geringer als die Masse eines Protons oder Neutrons. Dementsprechend ist es kaum verwunderlich, dass der Atomkern um einiges mehr Masse hat als die Atomhülle.
Atomaufbau: Hülle
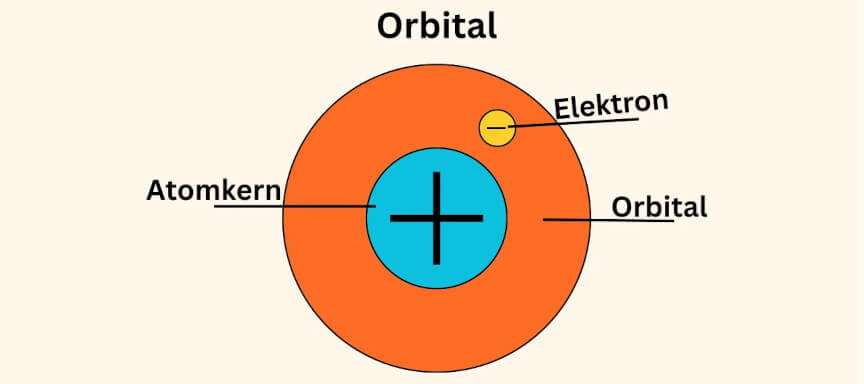
Wenden wir uns jetzt der Atomhülle zu. Sie besteht aus winzigen, negativ geladenen Teilchen, den Elektronen, die um den Atomkern kreisen. Jedoch kreisen sie nicht, wie früher angenommen, willkürlich um den Kern. Sondern sie bewegen sich in Räumen, den Orbitalen, um den Atomkern.
Auch wenn Elektronen, wie eben schon erwähnt, fast keine Masse haben, nehmen sie trotzdem den meisten Raum im Atom ein. Ihre Anordnung in der Atomhülle bestimmt, wie das Atom Verbindungen eingeht und mit anderen Atomen reagiert. Kurz gesagt, sein chemisches Verhalten.
Atomaufbau: Beispiele
Atomaufbau: Modelle
Atome sind so klein, dass wir sie nicht mit bloßem Auge sehen können, also entwickelten wir Modelle, um uns den Atomaufbau besser vorstellen zu können. Es gibt viele veraltete Modelle, die versuchen, den Atomaufbau der Atomhülle zu beschreiben, allerdings entsprechen diese nicht mehr dem wissenschaftlichen Stand von heute. Zwei zeitgemäße und realitätsnahe Modelle, auf die wir jetzt genauer eingehen werden, sind das Schalenmodell und das Orbitalmodell.
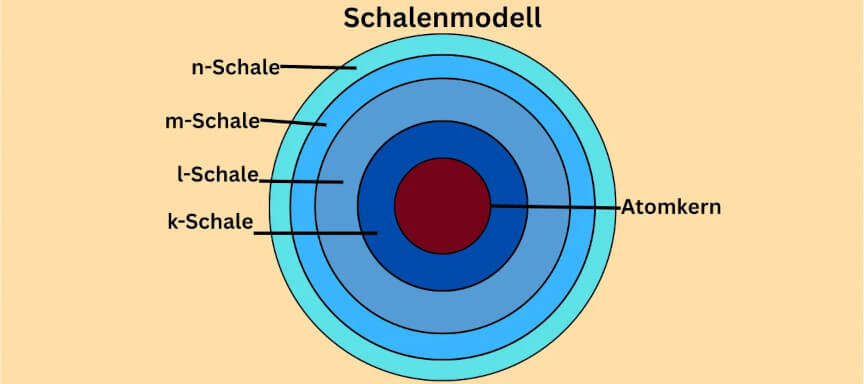
Schalenmodell
Im Schalenmodell kreisen die Elektronen in kreisförmigen Schalen um den Atomkern. Die einzelnen Schalen sind dabei in diskreten (festen) Abständen voneinander. Der Kern befindet sich im Zentrum aller Schalen.
Die einzelnen Schalen werden mit Elektronen besetzt. Die innerste Schale, auch k-Schale genannt, hat Platz für zwei Elektronen (n = 1) und wird als erstes besetzt. Die zweite Schale ist dementsprechend die l-Schale und wird mit acht Elektronen (n = 2) besetzt.
Um zu berechnen wie viele Elektronen auf eine Schale passen, nutzen wir diese Formel: 
 = Anzahl der Elektronen in der jeweiligen Schale
= Anzahl der Elektronen in der jeweiligen Schale = jeweilige Schale
= jeweilige Schale
In jeder Schale herrscht ein unterschiedliches Energieniveau. Je näher wir an den Kern herankommen, desto geringer ist das Energieniveau. Das Schalenmodell geht zudem davon aus, dass Elektronen zwischen den einzelnen Schalen springen können. Springt ein Elektron von einer Schale mit höherem in eine Schale mit niedrigerem Energieniveau, wird Energie freigesetzt. Andererseits wird Energie aufgewendet, wenn ein Elektron von einer Schale mit niedrigerem in eine Schale mit höherem Energieniveau springt.
Orbitalmodell
Das Orbitalmodell ist eine Weiterentwicklung des Schalenmodells und das aktuelle Modell des Atomaufbau. Statt auf festen Bahnen, wie im Schalenmodell, bewegen sich die Elektronen in Räumen, den sogenannten Orbitalen. Wir können uns Orbitale auch als Aufenthaltsbereiche für Elektronen vorstellen. Sie zeigen, wo sich die Elektronen mit hoher Wahrscheinlichkeit befinden, aber nicht exakt, wo sie gerade sind.
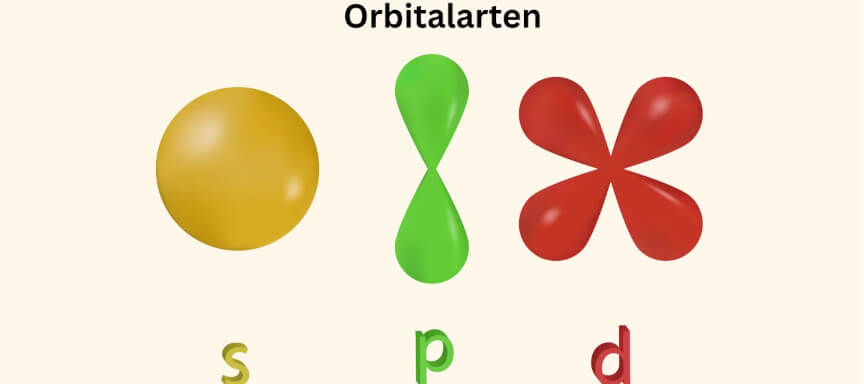
Orbitale können verschiedene Formen annehmen, z. B:
- kugelförmig (s-Orbital)
- hantelförmig (p-Orbital)
Jedes Orbital kann zudem jeweils maximal zwei Elektronen enthalten. Mathematisch gesehen, entsteht ein Orbital aus dem Betragsquadrat der Wellenfunktion, wobei die Wellenfunktion jegliche Informationen über das Atom hält.
Quantenzahlen
Quantenzahlen beschreiben ganz genau, wo sich Elektronen im Atom aufhalten, welche Schale, welches Orbital, welche Ausrichtung und welcher Energiezustand. Unterschieden wird zwischen 4 Quantenzahlen, die jede einen Zustand beschreiben.
Hauptquantenzahl (n) | gibt Orbitalgröße an, Hauptquantenzahl kann Werte (1, 2, 3,..., n) annehmen |
Nebequantenzahl (l) | gibt Orbitaltyp an, Nebenquantenzahl kann Werte (0, , 1, 2,..., n-1) annehmen |
Magnetquantenzahl (m) | gibt Orientierung im Raum an, Nebenquantenzahl kann Werte (-1,..., 0,..., +1) annehmen |
Spinquantenzahl (s) | gibt Drehsinn an, Elektron dreht entweder in paralleler Richtung oder entgegengesetzter Richtung, Spin nimmt entweder Wert +1/2 oder -1/2 an |
Zusammenfassung
Der Atomaufbau lässt sich fix und einfach erklären. Atome bestehen aus dem Atomkern (mit Protonen und Neutronen) und aus der Atomhülle (mit Elektronen). Während der Kern fast die ganze Masse enthält, bestimmt die Hülle das chemische Verhalten des Atoms.
Im Schalenmodell bewegen sich die Elektronen auf diskreten Bahnen um den Kern, im Orbitalmodell befinden sie sich in bestimmten Bereichen (Orbitalen). Um die Lage und Eigenschaften der Elektronen genauer zu beschreiben, nutzen wir die vier Quantenzahlen.